Intérêt de la rebiotisation après une désinfection anaérobique de sol
La protection des cultures contre les ravageurs et les bioagresseurs constitue un enjeu majeur pour les producteurs de légumes. En effet, la filière maraîchère est soucieuse de développer une production offrant des légumes de bonne qualité sanitaire et marchande. Elle doit s'adapter aux nouvelles contraintes réglementaires et aux attentes des consommateurs notamment concernant l'utilisation de produits phytopharmaceutiques avec les démarches « zéro résidu » et l'impact sur l'environnement avec la politique HVE - haute valeur environnementale, Global gap, Leaf.
Le maraîchage des Pays de la Loire est caractérisé par une utilisation intensive des sols sous un microclimat biologiquement favorable et un très faible nombre de familles botaniques. Ces paramètres conduisent à une très grande sensibilité aux problèmes liés aux bioagresseurs telluriques, qu'ils soient des champignons, des virus ou des bactéries. Dans ces conditions régionales, les agents pathogènes peuvent se maintenir plusieurs années dans les sols et entraîner des pertes de récolte pouvant conduire à des impossibilités de production. Des rotations sont faites sur les parcelles avec d'autres cultures légumières (salades entières ou en jeunes pousses, épinards, roquettes, etc.) mais ces cultures peuvent avoir des bioagresseurs communs (Rhizoctonia, Sclérotinia, Pythium, etc.) et ne constituent donc pas une solution à elle seule.
Jusqu'à présent, ces problèmes telluriques étaient masqués ou limités par l'usage de produits phytosanitaires, que ce soit en désinfection ou traitement des sols, ou en application en cours de culture. Mais ces solutions sont de plus en plus limitées. Le bromure de méthyl et le métham-sodium, deux fumigants chimiques à spectre large, ont successivement été interdits en 2005 et 2018 à cause de leurs effets négatifs sur l'environnement et/ou la santé humaine. Face à ces restrictions, les producteurs cherchent d'autres solutions pérennes. Différentes solutions chimiques sont disponibles avec des efficacités semblables ou en cours d'étude ou d'homologation. Cependant le risque de retrait ou de non-homologation de molécules incite les producteurs à se tourner vers des désinfections physiques (Culticlean, désinfection vapeur), biologiques (solarisation, biofumigation) ou vers l'utilisation de pratiques culturales (rotations, engrais verts).
Les désinfections du sol, qu'elles soient biologique ou thermique, créent un vide ou un désordre biologique (biological vacuum en anglais) [1]. Le vide microbiologique dans le sol après la décontamination peut être comblé par toutes bactéries ou champignons survivants y compris s'ils sont pathogènes [1]. Les désinfections de sol génèrent une diminution de l'abondance et de la diversité de certaines communautés microbiennes bénéfiques [4]. De nombreuses études montrent l'importance de la diversité microbienne pour maintenir les services écosystémiques et la multifonctionnalité du sol [5]–[7]. Depuis quelques années, des solutions de biotisation sont étudiées et commercialisées pour améliorer la fertilité biologique du sol, les rendements des cultures de rente et/ou pour prendre la place des communautés pathogènes c'est-à-dire combler le vide à la suite de désinfections de sol. S'y retrouvent notamment des Rhizobium formant des nodosités avec les légumineuses, des champignons mycorhiziens (Rhizophagus irregularis) ou des bactéries PGP (Bacillus thuringiensis) facilitant l'accès aux nutriments, stimulant la croissance et dégradant la matière organique [8]. Des résultats très intéressants sont obtenus en grandes cultures et en foresterie, mais les applications en maraîchage sont encore rares. Cette faible utilisation s'explique, d'une part, par le prix assez coûteux de certains produits et, d'autre part, par le manque de connaissances concernant le moment optimal pour ajouter ces solutions après les désinfections de sol c'est-à-dire le moment où il n'y a plus aucune rémanence. En effet, les biotisants requièrent des conditions environnementales minimales (pH, matière organique) pour s'installer de manière effective. Si les sols ne fournissent pas les conditions nécessaires, les biotisants ne s'établiront pas correctement, ne seront pas actifs et ne produiront pas l'effet escompté. Ces connaissances ont des implications importantes pour la recherche sur la suppressivité des maladies.
Pour combler ces lacunes, deux essais ont été réalisés en 2022, en culture de mâche sous grand abri froid. Ces essais se déroulent dans le cadre du projet DESARM financé par FranceAgrimer et porté par l'ARELPAL. Des applications d'un mélange de LiFoFer (voir l'encadré La litière forestière fermentée LiFoFer), de thé de compost (voir l'encadré Le thé de compost) et d'un mélange microbien commercial ont été appliquées à la suite de trois modalités de désinfection anaérobique de sol (voir l'encadré La désinfection anaérobique de sol) et d'une désinfection vapeur. Les modalités des essais sont résumées dans la figure 1.
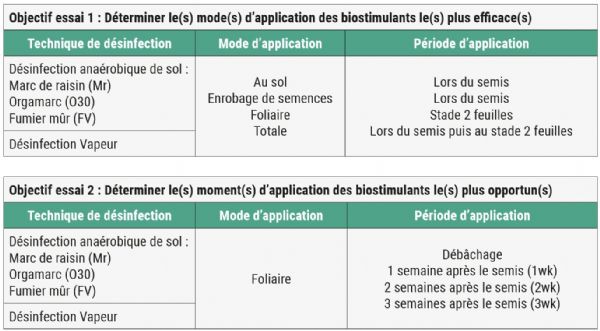
Pour les deux essais, les désinfections anaérobiques de sol sont mises en place mi-août pour une durée de huit semaines. Les résultats de la littérature suggèrent que la désinfection anaérobique de sol supprime de manière rapide et significative les agents pathogènes lorsque la température du sol atteint un minimum de 25 à 30 °C pendant au moins 10 jours. Néanmoins, une méta-analyse met en évidence que plus de 80 % de la suppression des agents pathogènes est réalisée lorsque la température est comprise entre 16 et 30 °C. Si la température du sol est relativement faible, inférieure à 15 °C, il est nécessaire d'adapter la dose et le temps d'incubation. Aux Pays-Bas, la désinfection anaérobique est limitée aux mois d'été, où les températures du sol n'atteignent généralement que 17 à 20 °C. Dans ces conditions, Ralstonia sp. et Verticillium sp. sont supprimés avec des taux d'amendements plus élevés qu'en conditions chaudes et des périodes d'incubation plus longues, entre 10 et 25 semaines [9].
Dans l'essai réalisé sur le centre CTIFL de Carquefou, la température sous les films imperméables est suivie pendant la durée de la désinfection. La température moyenne journalière est de 24,6 °C. Pendant les 30 premiers jours, des pics journaliers de températures sont observés jusqu'à 44,5 °C tandis que les températures minimales nocturnes ne descendent jamais sous les 15 °C. Pendant les quatre dernières semaines de désinfection, des pics journaliers autour de 30 °C sont observés tandis que la température nocturne la plus basse relevée est de 12,4 °C.
Un premier essai a été mené pour évaluer quelle est la forme d'apport de biostimulants la plus efficace pour promouvoir le développement de la mâche post-désinfection de sol. L'apport du biotisant est identique pour tous les substrats carbonés de la désinfection anaérobique de sol et pour la désinfection vapeur. De fait, par la suite, les valeurs sont traitées conjointement. L'application du mélange biotisant permet d'augmenter significativement le rendement lors des applications au sol (522 g pour 25 cm linéaire), en enrobage de semences (558 g pour 25 cm linéaire) et en application foliaire (257 g pour 25 cm linéaire) par rapport au témoin non biotisé (NR avec 223 g pour 25 cm linéaire) (Figure 2). Cet effet biostimulant pourrait s'expliquer par une amélioration du statut photosynthétique et du statut oxydatif des mâches. Des mesures réalisées par un capteur optique (Dualex®, Force A) mettent en évidence une augmentation significative de la teneur en chlorophylles (statut photosynthétique) et en anthocyanes (statut oxydatif) dans les modalités « Sol », « Semence » et « Foliaire ». Ainsi ces plantes présentent une meilleure vigueur que les mâches non rebiotisées (NR) ou les mâches ayant reçu l'intégralité des traitements (Totales) (Figure 2).
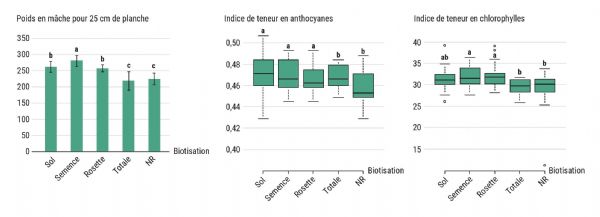
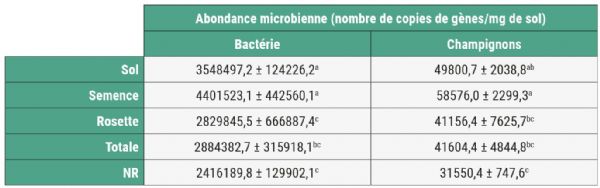
Les différentes modalités de biotisation ont également un impact sur l'abondance microbienne rhizosphérique. L'apport de biotisant au sol et en enrobage de semence entraîne une augmentation significative des abondances fongiques et bactériennes. À l'inverse, aucune modification n'est observée à la suite des apports foliaires ou totaux (Figure 3). L'analyse de la diversité microbienne permettra de connaître précisément quels sont les clades microbiens modifiés.
Pour le second essai, le mode d'application sélectionné est une application foliaire à différentes périodes. C'est en effet, à ce jour, le mode d'application le plus facilement transposable chez des producteurs. L'apport du biotisant est identique pour tous les substrats carbonés de la désinfection anaérobique de sol et pour la désinfection vapeur. De fait, par la suite, les valeurs sont traitées conjointement. L'application du mélange biotisant permet d'augmenter significativement le rendement lors de toutes les applications par rapport au témoin non biotisé (110 g pour 25 cm linéaire) (Figure 4). Néanmoins, la période la plus propice est celle à deux semaines (194 g pour 25 cm linéaire) après le débâchage. Ces promotions de croissance pourraient s'expliquer par les effets biostimulants et de biocontrôle du LiFoFer et du thé de compost tels que plusieurs fois relatés dans la littérature [10]. À titre d'exemple, en culture de pomme de terre, l'ajout d'un mélange de thé de compost et de micro-organismes au sol permet de diminuer l'incidence des pourritures et d'augmenter le rendement des tubercules [10].
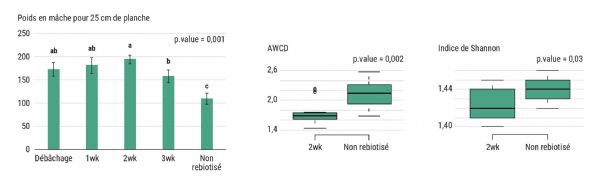
Le mélange affecte également le rhizobiome. L'activité globale (AWCD) et la diversité fonctionnelle microbienne (Indice de Shannon) sont significativement diminuées en réponse à l'ajout du mélange. Tong et al. [11] relatent que l'ajout de biotisant peut avoir pour effet de diminuer les populations oligotrophe et biotrophe au profit de communautés symbiotiques et très spécialisées. En culture de coton, l'abondance bactérienne rhizosphèrique diminue après une biotisation. L'abondance en bactéries biostimulantes, telles que les Micrococcaceae, les Nocardioidaceae et les Sphingomonadaceae, augmente de manière significative tandis que l'abondance relative des bactéries oligotrophes, telles que les Methylmirabilota, diminue.
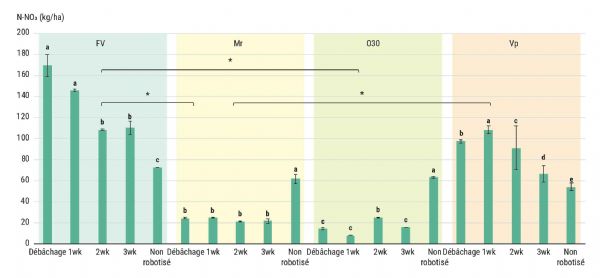
Aucune modification n'est observée concernant l'activité des cycles biogéochimiques du soufre, du carbone et du phosphore. À l'inverse, l'ajout du mélange modifie le cycle de l'azote. Vail et al. [12] ont observé que l'ajout de biotisant à base de thé de compost n'altère pas les cycles du carbone et du phosphore. Cependant, l'application du produit entraîne une augmentation significative de la teneur en azote du sol. Cette augmentation est supérieure à la teneur présente dans le biotisant lui-même. Aussi, l'augmentation est liée à des modifications de la biologie du sol [12]. Des résultats similaires sont obtenus dans les travaux menés sur le centre CTIFL de Carquefou. La figure 5 présente la teneur en nitrates dans le sol lors du stade récolte. Pour les substrats O30 (C/N = 11,9) et Mr (C/N = 25), l'ajout de biotisant diminue significativement la teneur en nitrates dans le sol. À l'inverse, pour la modalité vapeur et fumier (C/N = 15), la teneur en nitrates est fortement augmentée. En outre, il est observable que plus l'ajout de biotisant est précoce, plus la teneur en nitrates est importante.
Cette expérimentation met en évidence que la biotisation du sol post-désinfection permet d'améliorer la croissance de la mâche en intervenant au niveau du rhizobiome et du cycle de l'azote. À partir des données acquises, il est possible de choisir le moment adéquat pour favoriser à la fois le rendement tout en limitant le lessivage d'azote en fin de culture. Ces travaux sont à confirmer avec d'autres typologies de biotisant et dans d'autres contextes pédoclimatiques. À la vue de l'ensemble de ces résultats, l'utilisation de la désinfection anaérobique de sol semble présenter une solution qui pourrait être aussi intéressante que la vapeur pour décontaminer les sols. Cependant, la vapeur permet de diminuer la pression maladie mais également la pression adventice. Il est nécessaire de mesurer ce dernier paramètre pour juger de l'intérêt de la désinfection anaérobique de sol.
Et si la désinfection anaérobique de sol pouvait également améliorer la gestion des adventices ?
Très peu d'études ont traité l'influence de la désinfection anaérobique de sol sur l'enherbement des cultures, 88 expérimentations sont recensées dans 17 publications internationales [13]–[15]. Les désinfections anaérobiques de sol sont menées à la fois sous abri et en plein champ. Elles semblent fonctionner dans des climats estivaux très chauds comme la Floride et l'Andalousie où la température est supérieure à 30 °C mais aussi plus tempérés comme la région de Washington où la température extérieure oscille entre 16 et 26 °C ou bien frais comme au Népal où la température avoisine 15 à 20 °C [15], [16].
La mortalité des adventices durant le processus de désinfection anaérobique apparaît comme multifactoriel. Tout d'abord, pendant la phase anaérobique, la libération de composés peu oxydés tels que le méthane et l'éthylène, l'alcool, le sulfure d'hydrogène et les acides organiques, est toxique pour les graines d'adventices. D'autre part, les réactions exothermiques pendant la décomposition de la source de carbone et les effets de solarisation des films peuvent entraîner une mortalité accrue des graines imbibées et des jeunes plantules. Enfin, la longévité des semences d'adventices dans le sol est largement influencée par les communautés microbiennes du sol. Les sols possédant une activité microbienne plus élevée sont plus suppressifs vis-à-vis des adventices que les sols avec une activité biologique faible.
Les résultats obtenus dans la littérature rapportent des succès de la désinfection anaérobique sur un large spectre d'adventices dont certaines couramment retrouvées en maraîchage. Par exemple, le mouron blanc (Stellaria media) (60 à 74 % d'inhibition), le panic pied-de-coq (Echinolchloa crus-galli) (87 à 100 %), le chénopode blanc (Chenopodium album) (46 à 57 %) et la morelle noire (Solanum nigrum) (77 à 82 %) [15]. Cependant, la désinfection anaérobique de sol semble stimuler la prolifération d'amaranthe réfléchie (Amaranthus retroflexus) [9].
Au CTIFL, le sujet est étudié contre le souchet en Normandie et contre les adventices typiques des parcelles ligériennes sur le centre CTIFL de Carquefou. Les essais ont été menés en conditions contrôlées à partir de cinq sources de carbone, comparées à un faux semis ou à une désinfection vapeur (Vp). Les pourcentages d'enherbement des modalités de désinfection anaérobique de sol sont de 6,2 ± 1,5ab pour le marc de raisin, de 5,0 ± 2,9bc pour l'Herbie 72, de 6 ± 3abc pour le sorgho, de 4,3 ± 1,6bc pour le chlorofiltre et de 5,8 ± 2,8abc pour l'Orgamarc à 20 t/ha. Le témoin faux semis présente un pourcentage d'enherbement de 17,5 ± 1,6a et le témoin vapeur de 1,3 ± 0,8c. Ainsi, à l'exception de la modalité marc de raisin, toutes les sources de carbone présentent des résultats similaires à la vapeur et supérieurs à un faux semis.
L'utilisation de couverts végétaux comme source de carbone peut représenter une alternative intéressante à l'enherbement. Les couverts permettent d'augmenter la teneur en matière organique du sol et l'activité microbienne tout en réduisant le lessivage de l'azote en interculture [17]. Ils peuvent aussi maîtriser l'enherbement en interculture par allélopathie ou par compétition pour les ressources. En plus, la perturbation du sol pendant le semis du couvert et sa destruction favorisent la germination des adventices jouant ainsi un rôle de faux semis. Par ailleurs Jacob et al. 2019 rapportent, en culture de fraise, que l'incorporation de sorgho au sol en désinfection anaérobique permet un meilleur contrôle des adventices que l'incorporation seule ou que sa solarisation.
Davantage de travaux sont nécessaires pour améliorer l'efficacité de la technique dans nos conditions pédoclimatiques. Les facteurs à travailler sont les doses étant donné que les études menées actuellement préconisent un minimum de 10 tonnes de carbone par hectare ; la source de carbone car la comparaison entre des apports solides (compost, fumure, couverts) et liquide (éthanol, mélasse) met en avant une efficacité plus importante des sources liquides ; la température et le type de plastique puisque l'efficacité semble étroitement liée à la température du sol, il est donc important de tester des films permettant de réchauffer le sol plus rapidement et enfin, la durée de la désinfection anaérobique de sol dans la mesure où les études ont été menées entre trois semaines et plus de dix semaines, cette dernière durée semblant être la plus efficace.
Remerciements
Les auteurs remercient toutes les personnes et structures qui ont permis de mener ces travaux. Parmi eux, France Agrimer et Interfel pour le financement du projet DESARM ; l'IFV et Terrial pour la fourniture des sources de carbone nécessaires aux désinfections anaérobiques ; le laboratoire LVBM du CTIFL pour les analyses de biologie moléculaire et l'ARELPAL pour le portage administratif et financier du projet.
La litière forestière fermentée, LiFoFer
Encore très peu connue et développée dans le milieu agricole français il y a quelques années, l'utilisation de litière forestière fermentée (LiFoFer) a été largement développée et éprouvée en Asie et en Amérique Latine. La LiFoFer consiste à mettre en fermentation des matières végétales telles que feuilles mortes, résidus de céréales, son et mélasse, dans le but de créer une solution riche d'une diversité de micro-organismes endogènes.
La LiFoFer présente plusieurs avantages : la provenance essentiellement locale et la grande diversité des souches microbiennes utilisées. Ces souches microbiennes permettent de respecter, rétablir et soutenir l'équilibre naturel des agrosystèmes ciblés, tout en augmentant la probabilité de répondre positivement à la complexité des problématiques locales liant sols, plantes et animaux. La confection de la LiFoFer est accessible, que ce soit d'un point de vue technique ou financier et facilement réalisable à la ferme.
En 2019, une démarche d'actions participatives sur la LiFoFer a été mise en place par le FiBL, le CIRAD et l'IRD chez cinq producteurs volontaires. Les producteurs qui ont testé les solutions ont fait les observations visuelles suivantes : les cultures de salades sont plus précoces, se développent plus et présentent une pigmentation plus intense. Un essai mené sur tomate montre des fructifications plus précoces, une meilleure vigueur et une meilleure résistance à la sécheresse. Maintenant, pour envisager un développement de la solution à plus large échelle, les effets du LiFoFer doivent être scientifiquement évalués et crédibilisés.
Le thé de compost
Le thé de compost est une solution organique composée d'un mélange d'eau et de matières compostées matures incubées. La durée d'incubation, le ratio eau/compost et l'origine de la matière compostée sont autant de variables qui affectent la qualité et le pouvoir biostimulant du thé de compost.
Les thés de compost contiennent des éléments minéraux, des régulateurs de croissance, des acides humiques et fulviques ainsi que de nombreux micro-organismes [18]. La diversité en éléments des thés de compost conduit à l'observation de multiples effets de biostimulation et de biocontrôle. Les thés de compost peuvent également améliorer la structure et la vie microbienne du sol mais ont une durée de vie relativement courte et nécessitent des applications fréquentes et répétées. Pour exemple, des essais sur tomate en aspersion foliaire ou en arrosage, montrent que les thés de compost améliorent la croissance foliaire et racinaire, la surface foliaire, le statut azoté et potassique des feuilles ainsi que leur capacité antioxydante [19].
La désinfection anaérobique de sol
La désinfection anaérobique des sols est une méthode alternative aux traitements chimiques (Figure A). Elle réduit un grand nombre de maladies des sols, de ravageurs et de mauvaises herbes. La méthode nécessite l'incorporation dans le sol d'une matière organique facilement dégradable. Le sol est ensuite recouvert d'un film de plastique étanche à l'air pour empêcher l'entrée d'oxygène, ce qui crée un environnement anaérobique. Tout l'oxygène est utilisé par les micro-organismes du sol pour la décomposition de la matière organique. Pour certains organismes, ces conditions anaérobiques sont à elles seules déjà mortelles. La matière organique poursuit sa décomposition par fermentation, ce qui libère des acides gras volatils qui sont eux mortels pour de nombreuses autres espèces d'organismes du sol. La vidéo de Best4Soil intitulée Désinfestation anaérobie des sols : Informations pratiques (https://best4soil.eu/videos/2/fr) montre le principe de la désinfestation anaérobiquee des sols.

Les données clés à retenir
Refertiliser le sol après une désinfection : l'utilisation de micro-organismes biostimulants - Apporter du vivant après une désinfection de sol
Deux essais ont étudié l'utilisation de thé de compost, de litière forestière fermentée Lifofer et d'un mélange microbien pour améliorer la vie du sol après une désinfection et pour accroître le rendement de la mâche. L'apport au sol, en enrobage de semences et en pulvérisation foliaire, permet de stimuler significativement la productivité de la mâche. Cet effet est observé à plusieurs périodes : en application post désinfection, au stade cotylédon ou à des stades plus avancés. Ces effets s'expliquent par une meilleure vigueur des mâches et par des modifications de l'abondance et de la diversité fonctionnelle des communautés microbiennes. Outre un intérêt sur les maladies telluriques, la désinfection anaérobique du sol présente également un intérêt contre l'enherbement des parcelles. L'intégralité de ces résultats sera vérifiée par des essais en parcelles de producteurs.
Key points
The use of biostimulant microorganisms to re-fertilize the soil after disinfection - Bringing life after soil disinfection
The use of compost tea, LiFoFer made of fermented forest litter and a microbial mixture, to improve soil health after disinfection and to increase the yield of lamb's lettuce was studied through two trials. Soil application, as a seed coating and as a foliar spray, significantly improved the productivity of lamb's lettuce. This effect was observed at several periods: after the disinfection treatment, at the cotyledon stage or at more advanced stages. These effects are explained by better fitness of the crop and by changes in the abundance and functional diversity of the microbial communities. In addition to having a positive effect on soil-borne diseases, anaerobic soil disinfection also has a beneficial effect to control weeds. All of these results will be verified by trials in growers' plots.
Bibliographie / Sitographie
[1] J. B. Gurtler, «Pathogen decontamination of food crop soil: A review,» J. Food Prot., vol. 80, no. 9, pp. 1461-1470, 2017, doi: 10.4315/0362-028X.JFP-17-040.
[2] Ctifl, «La solarisationsous abris et en plein champs,» Le Point sur les méthodes Altern., vol. 10, pp. 1-5, 2012.
[3] W. Parmé, C. Ade, and S.-P. Pierre, «Gestion des bioagresseurs telluriques par l'utilisation de pratiques améliorantes - Projet Pathosol,» 2016.
[4] H. Guo, X. Zhao, E. N. Rosskopf, F. Di Gioia, J. C. Hong, and D. H. McNear, «Impacts of anaerobic soil disinfestation and chemical fumigation on soil microbial communities in field tomato production system,» Appl. Soil Ecol., vol. 126, no. March, pp. 165-173, 2018, doi: 10.1016/j.apsoil.2017.12.018.
[5] P. Mariotte et al., «Plant-Soil Feedback: Bridging Natural and Agricultural Sciences,» Trends Ecol. Evol., vol. 33, no. 2, pp. 129-142, 2018, doi: 10.1016/j.tree.2017.11.005.
[6] P.-A. Maron et al., «High microbial diversity promotes soil ecosystem functioning,» Appl. Environ. Microbiol., vol. 84, no. 9, 2018.
[7] P. Lemanceau et al., «Understanding and managing soil biodiversity: a major challenge in agroecology,» Agron. Sustain. Dev., vol. 35, no. 1, pp. 67-81, 2015, doi: 10.1007/s13593-014-0247-0.
[8] L. K. Abbott, L. M. Macdonald, M. T. F. Wong, M. J. Webb, S. N. Jenkins, and M. Farrell, «Potential roles of biological amendments for profitable grain production - A review,» Agric. Ecosyst. Environ., vol. 256, no. August 2017, pp. 34-50, 2018, doi: 10.1016/j.agee.2017.12.021.
[9] U. Shrestha, R. M. Augé, and D. M. Butler, «A meta-analysis of the impact of anaerobic soil disinfestation on pest suppression and yield of horticultural crops,» Front. Plant Sci., vol. 7, no. AUG2016, pp. 1-20, 2016, doi: 10.3389/fpls.2016.01254.
[10] R. P. Larkin, «Relative effects of biological amendments and crop rotations on soil microbial communities and soilborne diseases of potato,» Soil Biol. Biochem., vol. 40, no. 6, pp. 1341-1351, 2008, doi: 10.1016/j.soilbio.2007.03.005.
[11] L. Tong, M. Tao, R. Sibo, and L. Junhua, «Response of cotton root growth and rhizosphere soil bacterial communities to the application of acid compost tea in calcareous soil,» Appl. Soil Ecol., vol. 177, no. 104523, 2022, doi: 10.1016/j.apsoil.2022.104523.
[12 D. C. Vail, D. L. Hernández, E. Velis, and A. Wills, «Compost tea production methods affect soil nitrogen and microbial activity in a northern highbush blueberry system,» Agroecol. Sustain. Food Syst., vol. 44, no. 10, pp. 1370-1383, 2020, doi: 10.1080/21683565.2020.1724583.
[13] U. Shrestha, «Anaerobic Soil Disinfestation : Meta-analysis and Optimization of Amendment Carbon Rate and C : N Ratio to Control Key Plant Pathogens and Weeds,» 2016.
[14] D. Liu, J. B. Samtani, C. S. Johnson, D. M. Butler, and J. Derr, «Weed Control Assessment of Various Carbon Sources for Anaerobic Soil Disinfestation,» Int. J. Fruit Sci., vol. 20, no. sup1, pp. 1005-1018, 2020, doi: 10.1080/15538362.2020.1774472.
[15] R. B. Khadka, J. Cardina, and S. A. Miller, «Perspectives on Anaerobic Soil Disinfestation for Weed Management,» vol. 12, 2021.
[16] R. B. Khadka, M. Marasini, R. Rawal, A. L. Testen, and S. A. Miller, «Effects of anaerobic soil disinfestation carbon sources on soilborne diseases and weeds of okra and eggplant in Nepal,» Crop Prot., no. May, p. 104846, 2019, doi: 10.1016/j.cropro.2019.104846.
[17] A. L. Testen, F. Rotondo, M. P. Mills, M. M. Horvat, and S. A. Miller, «Evaluation of Agricultural Byproducts and Cover Crops as Anaerobic Soil Disinfestation Carbon Sources for Managing a Soilborne Disease Complex in High Tunnel Tomatoes,» vol. 5, no. May, pp. 1-12, 2021, doi: 10.3389/fsufs.2021.645197.
[18] S. M. Alturki, T. A. Shalaby, A. M. Almadini, and H. R. El-Ramady, «The nutritional status of tomato seedlings and peroxidase activity under foliar applications of some biostimulants,» Fresenius Environ. Bull., vol. 29, no. 1, pp. 421-433, 2020.
[19] D. Amos, «PRACTICE ABSTRACT NO . 016 Aerated compost tea ( ACT ) to improve soil biology and to act as a biofertiliser / biofungicide,» Pract. Abstr., vol. 16, p. 2, 2017.





